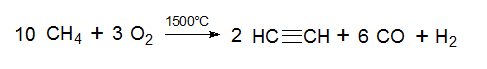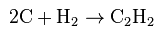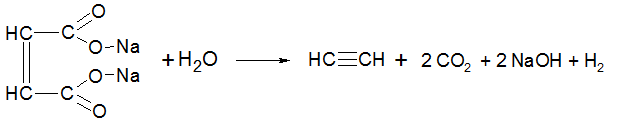Способы получения ацетилена в промышленности
Производство ацетилена (стр. 1 из 3)
ПРОЦЕСС ПОЛУЧЕНИЯ АЦЕТИЛЕНА ТЕРМООКИСЛИТЕЛЬНЫМ ПИРОЛИЗОМ
1. Товарные и определяющие технологию свойства ацетилена
Ацетилен С2 Н2 обладает более высокой реакционной способностью, чем олефины. Он является одним из важнейших исходных соединений для синтеза большого числа разнообразных органических продуктов.
Ацетилен — бесцветный газ, обладающий в чистом виде слабым эфирным запахом; конденсируется при —83,8°С (0,102 МПа); критическая температура +35,5 °С; критическое давление 6,04 МПа. Он имеет очень широкие пределы взрываемости в смеси с воздухом [2,0—81 % (об.) С2 Н2 ] и с кислородом [2,8—78 %(об.) С2 Н2 ]. Взрывоопасность ацетилена усугубляется из-за высокой экзотермичности его разложения на простые вещества:
Это разложение идет в отсутствие кислорода при наличии соответствующих инициаторов (искра, перегрев из-за трения). При давлении до 0,2 МПа разложение имеет местный характер и не является опасным. При более высоком давлении разложение приобретает характер взрыва с детонационной волной, распространяющейся со скоростью свыше 1000 м/с. Однако взрывоопасность ацетилена снижается при его разбавлении инертными газами или парами, которые аккумулируют тепло первичного разложения ацетилена и препятствуют его взрывному распаду. При этом максимальное безопасное давление смеси зависит от концентрации ацетилена (рис. 1). Взрывоопасность ацетилена сильно возрастает в присутствии металлов, способных к образованию ацетиленидов (например, Сu2 С2 ), что надо иметь в виду при выборе конструкционных материалов.
Для предохранения от взрывов чаще всего ограничивают давление при производстве ацетилена и различных синтезах безопасными пределами—0,2 МПа.) При необходимости работы под давлением разбавляют ацетилен азотом, а иногда парами реагентов. При сжатии ацетилена применяют специальные ацетиленовые компрессоры, имеющие низкую скорость перемещения движущихся частей, малую степень сжатия и температуру газа после каждой ступени компрессора не более 100°С. При расчете аппаратуры и трубопроводов принимают повышенный запас прочности. Кроме того, применяют специальные предохранительные устройства, размещаемые в разных точках технологической схемы. Из них сухие затворы (в виде шарикового клапана) предохраняют только от распространения пламени. Мокрые огнепреградители и гидравлические затворы защищают предшествующую аппаратуру от распространения взрыва. Огнепреградитель представляет собой башню с насадкой, орошаемую водой, а гидравлическим затвором служит аппарат, в котором ацетилен барботирует через слой воды. Во всех случаях при превышении установленного давления сбрасывают газы в атмосферу через гидравлические затворы или предохранительные мембраны.
Другим технически важным свойством ацетилена является его растворимость, значительно более высокая, чем у других углеводородных газов. Так, в 1 объеме воды при 20 °С растворяется около 1 объема ацетилена, а при 60 °С растворяется 0,37 объема. Растворимость снижается в водных растворах солей и Са(ОН)2 . значительно выше растворимость ацетилена в органических жидкостях; при 20 °С и атмосферном давлении она составляет (в объемах ацетилена на 1 объем растворителя): в метаноле 11,2, в ацетоне 23, в диметилформамиде 32, N-метилпирролидоне 37. Растворимость ацетилена имеет важное значение при его получении и выделении из смесей с другими газами, а также в ацетиленовых баллонах, где для повышения их емкости по ацетилену и снижения давления используют растворитель (ацетон).

Рис 1 Зависимость максимально допустимого безопасного давления от концентрации ацетилена в смеси с азотом
2. Сырьевые источники получения ацетилена. Перспективы использования различного сырья
Карбид кальция получают из оксида кальция и кокса в электродуговых печах. Реакция сильно эндотермична и требует больших затрат электроэнергии, что составляет существенный элемент в себестоимости производимого ацетилена.
Исходным сырьем для получения ацетилена могут служить газообразные парафиновые углеводороды (метан, этан, пропан, бутаны) и жидкие нефтяные фракции, например прямогонные бензины.
Выбор углеводородного сырья зависит от многих факторов, в совокупности определяющих экономичность процесса в целом, от наличия ресурсов сырья, расхода энергии, выхода ацетилена и его концентрации в продуктах реакции, от количества и стоимости побочных продуктов и возможности их рентабельного использования.
Значительный интерес как источник сырья представляют дешевые нефтяные остатки. Установлено, что при пиролизе тяжелых углеводородов можно получать с высоким выходом ацетилен, концентрация которого в продуктах реакции достигает 31 – 33 %; кроме ацетилена, в них содержится 54 – 58 % водорода и 10 – 12 % олефинов, главным образом этилена. При переработке же газообразных углеводородов содержание ацетилена в продуктах реакции составляет от 7 до 16 %.
Однако промышленная технология переработки гудрона и других нефтяных остатков еще полностью не разработана, из-за чего это сырье пока не используется.
Энергетически наименее выгодным сырьем для получения ацетилена является метан. Для его пиролиза требуется затратить большее количество тепла (91 ккал/моль), в то время как для пиролиза этана и пропана требуется соответственно 78 и 61,9 ккал/моль. Пиролиз метана проводится при более высоких температурах, чем его гомологов. Однако метан используется для получения ацетилена на многих установках. Объясняется это тем, что метан – наиболее доступный и дешевый из углеводородов; он является основным компонентом природного газа, и последний может применяться для производства без разделения.
3.Современные промышленные способы получения ацетилена
Существуют два метода производства ацетилена: более старый – из карбида кальция и новый из углеводородов.
При разложении образовавшегося карбида кальция водой по экзотермической реакции получается ацетилен:

Из 1 кг технического карбида кальция, содержащего примеси кокса, оксида кальция и других веществ, получается 230—280 л ацетилена (эта величина называется литражом карбида). Теоретически из 1 кг чистого СаС2 должно образоваться 380 лС2 Н2 .
При разложении карбида кальция следует соблюдать некоторые условия для нормального протекания процесса. Реакция является гетерогенной, и ее скорость зависит от размера кусков карбида, особенно сильно возрастая при использовании карбидной мелочи и пыли. Реакционную массу необходимо перемешивать так как иначе на кусках карбида может образоваться слой извести, препятствующий полному разложению карбида и приводящий к местным перегревам. Из реакционной зоны нужно постоянно отводить тепло, чтобы предохранить ацетилен от возможной полимеризации и разложения.
По способу подвода тепла для проведения высокоэндотермичной реакции пиролиза углеводородов в ацетилен различают четыре метода.
1). Регенеративный пиролиз в печах с огнеупорной насадкой; ее сперва разогревают топочными газами, а затем через раскаленную насадку пропускают пиролизуемое сырье. Эти периоды чередуются.
2). Электрокрекинг при помощи вольтовой дуги, когда углеводородное сырье подвергают пиролизу в электродуговых печах при напряжении между электродами 1000 В. Затраты электроэнергии доходят до 13 000 кВт-ч на 1 т ацетилена, что составляет главный недостаток метода.
3). Гомогенный пиролиз, когда сырье вводят в поток горячего топочного газа, полученного сжиганием метана в кислороде и имеющего температуру 2000°С. Этот метод можно комбинировать с другими процессами пиролиза, если в горячие газы первой ступени пиролиза вводить пары жидких углеводородов, для расщепления которых в ацетилен требуется более низкая температура. Возможно и совместное получение ацетилена и этилена.
4). Окислительный пиролиз, при котором экзотермическая реакция горения углеводородов и эндотермический процесс пиролиза совмещены в одном аппарате.
Все эти способы пиролиза углеводородов на ацетилен применяют в промышленности, но наиболее экономичным из них является окислительный пиролиз.
4. Физико-химические основы процесса получения ацетилена методом термоокисленного пиролиза метана.
Из метана и других парафинов ацетилен получают путем высокотемпературного пиролиза по следующим обратимым реакциям:

Эти реакции эндотермичны, и их равновесие смещается вправо только при 1000—1300°С. Однако при практическом осуществлении процесса с целью его ускорения требуется более высокая температура: 1500—1600°С для метана и 1200°С для жидких углеводородов.
Подобно пиролизу на олефины, реакции образования ацетилена имеют радикально-цепной механизм, причем цепь превращений метана и этана можно представить примерно так:

В полученном газе кроме низших парафинов и олефинов содержится небольшое количество бензола и ацетиленовых углеводородов — метилацетилена СН3 —С
Получение ацетилена данным методом осложняется побочной реакцией его разложения на углерод и водород. Она становится заметной при 1000°С и достигает значительной скорости при 1200—1600°С, т. е. при температуре, требуемой для получения ацетилена. В результате наблюдается система последовательных реакций, при которой образующийся ацетилен разлагается на водород и углерод (сажу):
Ацетилен
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.

Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.

Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.

Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена

Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
- для получения яркого света в автономных источниках света (карбидная лампа);
- при изготовлении взрывчатых веществ, это уже упоминавшиеся ацетилениды;
- получения некоторых химических веществ, например, уксуса, спирта, полимеров и пр;
- кроме этого, ацетилен нашел свое применение и в ракетной технике, в качестве компонента топлива.
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Скачать ГОСТ 5457-75
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.

Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые характеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в предохранении газа от распада.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Ацетилен, получение, свойства, химические реакции
Ацетилен, получение, свойства, химические реакции.




Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород , состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:

Ацетилен имеет тройную связь между атомами углерода .
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород , сероводород и пр., которые придают ему резкий запах.
Легче воздуха . Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ . Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом , метаном или пропаном .
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух , может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны , заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде . Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
Реакция протекает стадийно с образованием производных алканов .
В ходе данной реакции ацетилен обесцвечивает бромную воду .
- 2. гидрогалогенирование ацетилена:
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, t o = 450-500 о С).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 о С.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 ( этилен ) (kat = Ni, Pd или Pt, повышенная t o );
СH≡CH + 2Н2 → C2H6 ( этан ) (kat = Ni, Pd или Pt, повышенная t o ).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
- 2. дегидрирования метана:
- 3. дегидрирования этилена:
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (t o = 900-1200 о С).
Затем получают карбид кальция , сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (t o = 2500-3000 о С).
Далее карбид кальция обрабатывают водой по известной реакции.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы .
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа ( аргона или водорода ).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей , пластических масс, синтетических каучуков , ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода ,
– как источник очень яркого, белого света в автономных светильниках , где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см 2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см 2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами , например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью , серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы , содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com




как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен
Ацетилен

Ацетилен
Название этого вещества связано со словом «уксус». Сегодня это единственный широко используемый в промышленности газ, горение и взрыв которого возможны в отсутствие кислорода или других окислителей. Сгорая в кислоте, он дает очень горячее пламя — до 3100°С.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + 2Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина, арсина.
Ацетилен сегодня: способы получения
В промышленности ацетилен часто получают действием воды на карбид кальция.
Сейчас широко применяются методы получения ацетилена из природного газа – метана:
электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена);
термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Применение
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды,
- в производстве взрывчатых веществ,
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Свойства ацетилена
В химически чистом виде ацетилен обладает слабым эфирным запахом. Технический ацетилен, благодаря наличию в нем примесей, в частности фосфористого водорода, имеет резкий специфический запах. Ацетилен легче воздуха. Газообразный ацетилен – бесцветный газ молекулярная масса – 26,038.
Ацетилен способен растворяться во многих жидкостях. Его растворимость зависит от температуры: чем ниже температура жидкости, тем больше она способна «забрать» ацетилена. В практике производства растворенного ацетилена используют ацетон, который при температуре 15 °С растворяет до 23 объемов ацетилена.
Содержание фосфористого водорода в ацетилене должно быть строго ограничено, так как в момент образования ацетилена в присутствии воздуха при высокой температуре может произойти самовоспламенение.
Ацетилен — единственный широко используемый в промышленности газ, относящийся к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Еще в 1895 г. А.Л.Ле Шателье обнаружил, что ацетилен, сгорая в кислоте, дает очень горячее пламя (до 3150°С), поэтому его широко используют для сварки и резки тугоплавких металлов. Сегодня применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и т.д.). Однако преимущество ацетилена — в самой высокой температуре горения. В таком пламени очень быстро расплавляются даже толстые куски стали. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ — уксусного альдегида и уксусной кислоты, синтетических каучуков (изопренового и хлоропренового), поливинилхлорида и других полимеров.
ПЕРЕВОЗКА. Техническим растворенным ацетиленом наполняют стальные баллоны для растворенного ацетилена с пористой массой (активным углем или литой пористой массой) и ацетоном. Баллоны окрашены в белый цвет и оснащены вентилями специальных типов, предназначенными для ацетиленовых баллонов. Растворенный ацетилен в баллонах перевозят всеми видами транспорта в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта.
Ацетилен: химические свойства, получение, применение, меры предосторожности
Ацетилен (или по международной номенклатуре — этин) — это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена — C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода — наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Физические свойства ацетилена
Ацетилен — это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
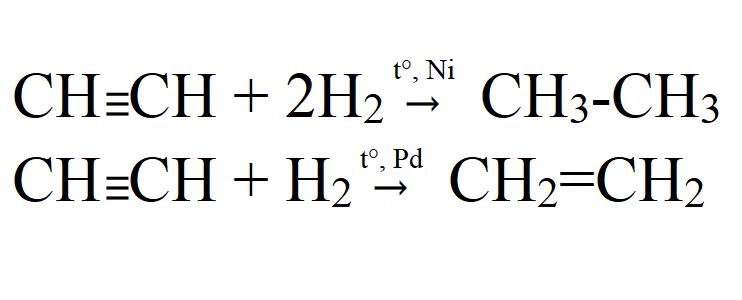
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
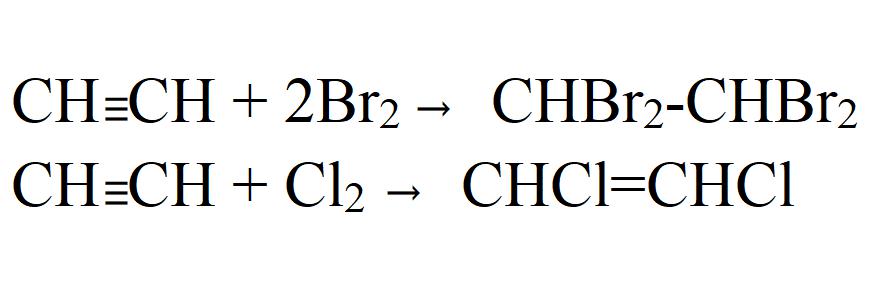
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.

- Присоединение синильной кислоты.
- Взаимодействие ацетилена с металл-органическими соединениями.
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.
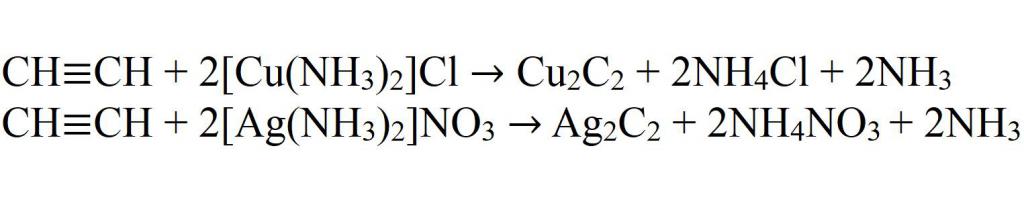
- Взаимодействие с амидом натрия.
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор — соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл — циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
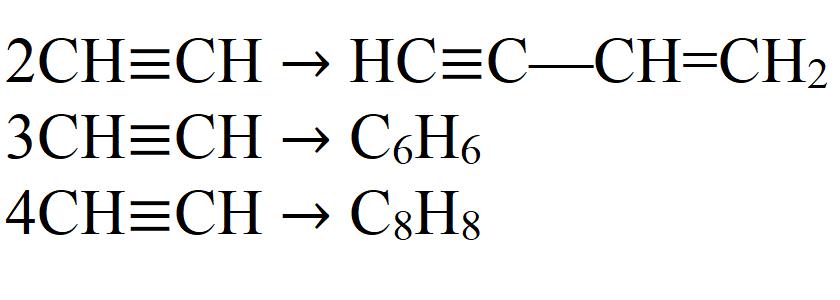
Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой — около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен — огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
Получение алкинов
В современном мире ацетилен и его гомологи имеют большое значение. Они являются исходным веществом для многих простых и сложных органических соединений. Поэтому немаловажное значение имеет изучение возможных способов получения ацетилена и других алкинов, изучение экономической эффективности и целесообразности. Далее рассмотрим получение алкинов в лаборатории и промышленности, а также области их применения.
Получение ацетилена
- Из карбида кальция путем нагрева в электрической печи (
2500°С) смеси негашеной извести и кокса. Полученный карбид кальция разлагают водой с образованием ацетилена (метод Велера, 1862 г.):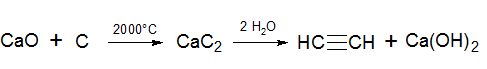
- Из углеводородов путем их пиролиза. Обычно сырьем служат газообразные предельные углеводороды (в частности метан) или жидкие фракции нефти (прямогонные бензин, керосин):

- Из элементов ацетилен можно получить пропуская вольтову дугу между угольными электродами в атмосфере водорода. В свое время Бертло так получил ацетилен. Метод не используется на практике, но исторически важен:

- Из солей непредельных карбоновых кислот. В 1864 г. Кекуле получил ацетилен путем электролиза фумарата натрия:

Данный способ получения ацетилена важен только с исторической точки зрения и не имеет практического значения
Способы получения алкинов
1) Из олефинов. Получение алкинов путем последовательного присоединения к олефинам молекулы галогена и отщепления двух молекул галогенводорода при воздействии спиртового раствора щелочи: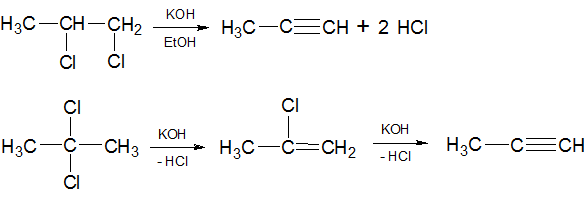
При воздействии цинка на полигалогеналканы также образуются алкины:
2) Из кетонов. Путем воздействия хлористого фосфора на кетон (150-170°С) замещают кислород на два хлора и отщепляя от образовавшегося соединения двух молекул галогенводорода получают алкин: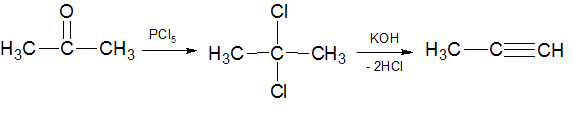 3) Из солей ацетиленовых углеводородов путем их алкилирования получают алкины с большим числом углеродных атомов:
3) Из солей ацетиленовых углеводородов путем их алкилирования получают алкины с большим числом углеродных атомов: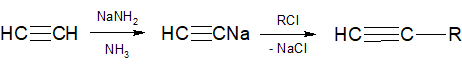
Применение алкинов
Наибольшее значение и применение среди алкинов имеют ацетилен и винилацетилен.
Большая доля производимого ацетилена идет на сварку и резку металла. Ацетиленово — кислородное пламя имеет температуру — порядка 3500°С, что позволяет легко плавить сталь.
Некоторая часть ацетилена из-за его наркотического воздействия применяется в медицинской практике (нарцилен).
Как исходное вещество ацетилен используется в производстве соединений органического синтеза и целевой химической продукции — уксусной кислоты, ацетальдегида, этанола, хлоруксусные кислоты, изопрена, винилацетилена, который далее используется при получении хлоропренового каучука и т.п.