Структурная формула углекислого газа
Формула углекислого газа
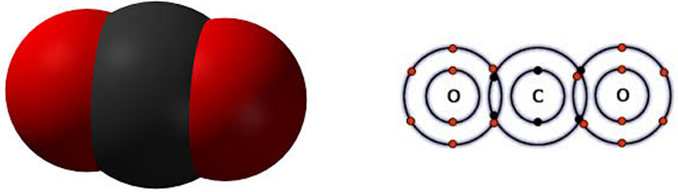
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
-
При растворении в воде образует угольную кислоту:
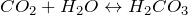
Взаимодействует с основными оксидами и основаниями, образуя карбонаты и гидрокарбонаты (соли угольной кислоты):
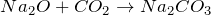
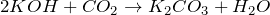
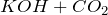 (избыток)
(избыток) 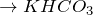
Не поддерживает горение, но при нагревании может окислять активные металлы:
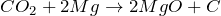
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
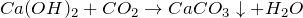
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
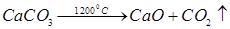
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
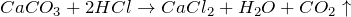
Примеры решения задач
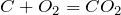
Рассчитаем количество вещества углерода по формуле:
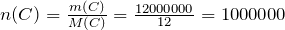 моль
моль
По уравнению реакции
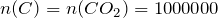 моль
моль
1 моль газа при нормальных условиях занимает объем 22,4л.
Рассчитаем теоретический объем углекислого газа:
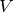 теор.
теор.  л
л 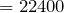 м
м 
Рассчитаем практический объем углекислого газа:
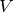 практ.
практ. 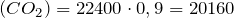 м
м 
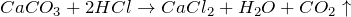
В процессе реакции образуется угольная кислота (H2CO3), которая сразу разлагается на воду (H2O) и углекислый газ (CO2).
Рассчитаем количество вещества углекислого газа по формуле:
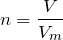
где Vm – молярный объем, т.е. объем, который занимает один моль газа при нормальных условиях. 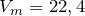 л/моль.
л/моль.
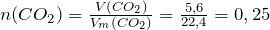 моль
моль
Для расчета количества вещества соляной кислоты составим пропорцию по уравнению реакции:
2 моль HCl приводят к образованию 1 моль CO2
x моль HCl приводят к образованию 0,25 моль CO2
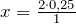 моль
моль
Молярная масса соляной кислоты равна 36,5 г/моль. Рассчитаем массу соляной кислоты:
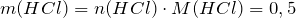 моль
моль 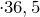 г/моль
г/моль 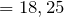 г
г
Выражение для массовой доли вещества в растворе:
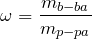
Рассчитаем массу раствора соляной кислоты по формуле:
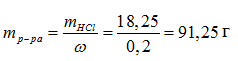
Если раствор HCl 20%, то массовая доля соляной кислоты в нем будет равна 0,20.
Рассчитаем объем раствора соляной кислоты по формуле:
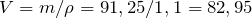 мл
мл
Углекислый газ молекулярная формула
Углекислый газ, или диоксид углерода, или CO2 — одно из самых распространенных на Земле газообразных веществ. Он окружает нас в течение всей нашей жизни. Углекислый газ не имеет цвета, вкуса и запаха и никак не ощущается человеком.

Он является важным участником обмена веществ живых организмов. Газ сам по себе не ядовит, но не поддерживает дыхание, поэтому превышение его концентрации ведет к ухудшению снабжения тканей организма кислородом и к удушью. Углекислый газ широко применяется в быту и в промышленности.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.

При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.

Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Молекула соединения характеризуется ковалентной полярной химической связью. Полярность обеспечивается большим значением электроотрицательности. Молярная масса вещества составляет 44.
Свойства углекислого газа
Углекислый газ не имеет запаха, цвета, вкуса, легко растворяется в воде. Это свойство используется при изготовлении газированных напитков. Физические свойства соединения:
- тяжелее воздуха в 1,5 раза;
- не поддерживает горение;
- плотность — 1,977 г/л;
- кристаллизуется при температуре -78,3ºC;
- сублимируется при -78 ºC;
- сухой лед испаряется при атмосферном давлении;
- в его атмосфере может поддерживаться горение щелочных и щелочноземельных металлов;
- в электрическом разряде светится бело-зеленым цветом;
- образуется при горении и гниении органических веществ.
При растворении в воде образуется смесь угольной кислоты и двуокиси углерода. Качественная реакция на углекислый газ характеризуется помутнением известковой воды. В результате взаимодействия гидроксида кальция образуется осадок — карбонат кальция.
Получение
Технология производства углекислоты отличается разнообразностью. Газ выделяется вместе с дымовыми отходами ТЭЦ и электростанций, при брожении спиртового состава. Абсорбирование газа предусматривает очистку, которая выполняется поэтапно в соответствии с установленными требованиями Государственного стандарта.
Газ на нефтеперерабатывающих предприятиях — путем адсорбции моноэтаноламином и карбонатом калия. Технология сбора углерода предусматривает подачу по трубопроводу веществ, которые насыщаются углекислотой.
При повышенной температуре или низком давлении происходит высвобождение чистого соединения и других продуктов распада. В лабораторных условиях извлечение CO2 возможно в результате реакции кислот и гидрокарбонатов.
Реакция происходит при низком давлении. После очистки газ попадает в компрессор, сжимается и восстанавливается в 2 адсорбера, очищается от второстепенных запахов и переводится в конденсат. Этот метод применяют при спиртовом брожении на пивоварнях.
Угольный ангидрит в твердом агрегатном состоянии (сухой лед) образуется путем обработки жидкости низкой температурой -56ºC. В промышленном производстве только 20% объема исходного вещества переходит в лед, а остальное количество превращается в газ.
Технология изготовления твердой углекислоты предусматривает промывку, сжатие, охлаждение газообразного углерода. После очистки активированным углем жидкость поступает в холодильник, затем направляется на испарение и под пресс.
Применение
Использование материала в различных отраслях связано с химическими и физическими свойствами вещества. Двуокись углерода безопасна для человека в низких концентрациях, является основным компонентом, поддерживающим жизнедеятельность человека. Газ не поддерживает горения, поэтому используется в системах пожаротушения.
При сварке металла предотвращает окисление и защищает от нагрева. Распыление газа в парнике стимулирует развитие растений, повышает урожайность. В медицине газ применяется для создания атмосферы при проведении операций, введении пациента в наркоз. В приборах и оборудовании вещество используется в качестве абразивного материала для прочистки.
В пищевой промышленности углекислота применяют в качестве консерванта при изготовлении напитков. Сухой лед используется в морозильных камерах, предназначенных для транспортировки. В производстве бумаги вещество регулирует водородный показатель целлюлозы или древесной массы.
Химическая промышленность использует угольный ангидрит для нейтрализации щелочей, регулирования температуры в реакциях, синтеза искусственных соединений. В металлургии двуокись углерода применяется для осаждения дыма, регулировки направления потока воды при отводе из шахт.
Компании по производству технических газов предлагают купить углекислоту, произведенную по всем требованиям и хранящуюся согласно ГОСТу. Заказ можно оформить на сайте организации, по телефону. Доставка осуществляется по предусмотренным условиям сотрудничества.
Что такое CO2


Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.

Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.

Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.