Характерные химические свойства меди
Свойства меди
Свойства меди, металла, который встречается и в виде довольно больших самородков, люди изучали еще в древности. Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения. Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности. В этой статье поговорим о свойствах меди и методах ее определения.
Физические свойства меди
Чистая медь – это металл, цвет которого варьируется от розового до красного оттенка. Радиус положительно заряженных ионов меди, может принимать такие значения:
- при координационном показателе равном 6-ти — до 0,091 нм
- при координационном показателе равном 2 — до 0,06 нм.
Радиус атома меди равняется 0,128 нм. Величина сродства к электрону достигает 1,8 эВ. Процесс ионизации данного атома увеличивает сродство к электрону от 7,726 до 82,7 эВ.
Медь является переходным металлом. Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга. Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м.
 Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Кроме вышеперечисленных, стоит выделить еще и такие физические и механические свойства меди:
- показатель термического линейного расширения составляет 0,00000017 единиц
- показатель предела прочности на растяжение достигает 22 кгс/мм2
- уровень твердости меди по шкале Бринелля равен 35 кгс/мм2
- удельная масса составляет 8,94 г/см3
- показатель упругости равен 132000 Мн/м2
- относительное удлинение равняется 60%.
Абсолютно неповторимыми можно назвать магнитные свойства этого металла, который является полностью диамагнитным. Именно благодаря этим показателям, вместе с физическими свойствами, к примеру, удельным весом и удельной проводимостью, можно объяснить такую широкую популярность этого металла в производстве изделий электротехнической отрасли. Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Единственная характеристика меди, которую можно изменить — это предел прочности. Этот показатель может быть улучшен почти в два раза (до 420–450 МН/м2), путем специальной технологической операции, называемой наклеп.
Химические свойства меди
Химическая характеристика меди определяется ее расположением в периодической таблице элементов Менделеева, где ей присвоен порядковый номер 29. Находится она в четвертом периоде и в одной группе с благородными металлами. Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Если уровень влажный не высокий, то медь почти не проявляет химической активности. Однако, все кардинально меняется, когда изделия помещают в условия высокой влажности и повышенного содержания углекислого газа. Именно такие условия являются идеальными для начала активного окисления меди. В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения.
 Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Медь довольно легко вступает в реакции с элементами, находящимися в группе галогенов. Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Взаимодействие с кислотами:
- результатом реакции с серной кислотой является сульфат и чистая медь
- с бромоводородной и иодоводородной кислотой соответственно образуются бромид и иодид меди.
А вот взаимодействие со щелочами позволяет получить купрат. Реакции получения меди, при которых происходит восстановление металла до свободного состояния, невозможны без присутствия оксида углерода, аммиака, метана и некоторых других веществ.
Основные свойства меди позволяют ей вступать во взаимодействие с раствором солей железа. Результатом такой реакции является восстановление железа. Эту реакцию применяют для снятия ранее напыленного медного слоя с разных изделий.
Свойства солей меди
Одно- и двухвалентная медь может формировать комплексные соединения, которые выделяются высоким уровнем устойчивости. К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.
Сульфат меди (II) — CuSO4 в безводном состоянии является белым порошком. При добавлении воды он приобретает синюю окраску. Поэтому его используют для выявления остатков воды в органических жидкостях. Водный раствор сульфата меди отличается сине-голубым оттенком. За этот цвет отвечают гидратированные ионы [Cu(H2O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
Из водного раствора сульфат меди кристаллизуется с пятью молекулами воды, путем формирования прозрачных синих кристаллов медного купороса. Полученное соединение используется:
- в процессе электролитического нанесения меди на металлы
- для создания минеральных красок
- как исходный материал для получения прочих соединений меди.
 В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
Хлорид меди (II) — CuCl2. 2H2O. Это легко растворимое в воде соединение темно-зеленого цвета. Высокая концентрация хлорида меди позволяет получить растворы зеленого цвета, а разбавление приводит к окраске в сине-голубой оттенок.
Нитрат меди (II) — Cu(NO3)2.3H2O. Его получают путем растворения меди в азотной кислоте. В процессе нагревания синие кристаллы нитрата меди сначала отдают воду, после чего с легкостью разлагаются, выделяя кислород и бурый диоксид азота, становясь оксидом меди (II).
Гидроксокарбонат меди (II) — (CuOH)2CO3. Данное вещество можно встретить в природе в виде минерала малахита, который отличается красивым изумрудно-зеленым цветом. В лабораторных условиях его можно создать при помощи действия Na2CO3 на растворы солей меди (II).
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
Кроме этого, его используют, чтобы получить хлорид меди (II), а также приготовить синие и зеленые минеральные краски.
 Ацетат меди (II) — Cu (CH3COO)2.H2O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Ацетат меди (II) — Cu (CH3COO)2.H2O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Помните, что все без исключения соли меди являются ядовитыми. По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
Методы определения меди
Определение меди может проводиться такими методами:
- химическими
- количественными
- фотометрическими.
Различные химические составы способны оказывать влияние на расщепление молекул и атомов вещества, следовательно, можно выделить его составные части. Химический метод определения количества заключается в электролитическом методе измерения медной части в сплавах других металлов. Его осуществляют при помощи таких элементов:
- ацетилен
- винная кислота
- водный аммиак
- азотнокислый аммоний
- динатриевая соль
- этиловый спирт
- купризон.
Прежде всего, происходит взвешивание медного состава (навески). После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
Контрольным испытанием является повторный процесс электролиза. Необходимо электроды погрузить в раствор, ниже уровня выделенной меди и подключить ток. При правильном проведении первой реакции, во время контрольной процедуры вы не увидите налета металла. Полученный таким образом медный катод нужно промыть водой, не отключая электроток, а потом обработать этиловым спиртом и высушить. После этого катод необходимо взвесить, и сопоставить массу с первоначальным весом. Итак, вы получите удельный вес меди в соединении.
Разработано большое количество видов химических растворов для очистки медных изделий.
Количественное определение массы меди в общем объеме металла целесообразно использовать для сплавов с никелем, бронзой или цинком. При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить. Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
- тетрароданодиаминхромиат аммония, называемый солью Рейнеке
- тиокарбонат калия способен осадить медь при температуре выше 80 оС
- уксусной кислотой можно осадить медный оксалат.
Из органических веществ применяются:
- оксихинолин-8, который способен осадить медь в комплексе с аммиачным и щелочным раствором. Нагревание осадка приводит к образованию оксида меди
- α-бензоиноксим при участии спирта может осадить металл в форме хлопьев. Реакция невозможна, если в составе есть никель
- йодид калия применяют в нейтральной и кислой среде. Нет смысла использовать его, когда в сплаве имеется железо, сурьма и мышьяк.
Достоинства фотометрического метода заключаются в высоком показателе точности измерения количества меди, а также простота применения. Для реализации этого метода потребуются такие соединения:
- купризон
- диэтилдитиокарбамат свинца.
Смысл фотометрического метода определения меди состоит в фиксации интенсивности цвета материала, прошедшего через концентрированный раствор. Раствор состоит из:
- аммиака
- лимоннокислого раствора аммония
- диэтилдитиокарбамата свинца
- сернокислого натрия.
 Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Определение меди возможно также и в сточных, канализационных, речных, морских водах, и в составе почве. Существует три способа:
- атомноабсорбционный прямой
- атомноабсорбционный при участии хелатообразования
- атомноабсорбционный, подразумевающий использование графитовой печи.
Чтобы определить количество меди в почве самым надежным методом является метод с использованием графитной печи.
Для этого пробу почвы нужно поместить в графитовую трубу, обезводить при помощи сжигания и распылить. Процедура распыления сопряжена с разделением вещества на атомы, с последующей фильтрацией и выделением из них нужного металла. Чтобы оценить пробу грунта можно воспользоваться любым фотометрическим методом определения меди.
Медь — свойства, характеристики свойства
 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.

2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.

Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Медь (Cu)
Медь (купрум, свое название получила в честь острова Кипр, где было открытое крупное медное месторождение) является одним из первых металлов, который освоил человек — Медный век (эпоха, когда в обиходе человека преобладали медные орудия) охватывает период IV—III тысячелетия до н. э.
Сплав меди с оловом (бронза) был получен на Ближнем Востоке за 3000 лет до н. э. Бронза была предпочтительней меди, поскольку была более прочна и лучше поддавалась ковке.
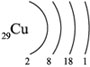
Среднее содержание меди в земной коре составляет 4,7-5,5·10 -3 % по массе. Медь присутствует в природе, как в виде самородков, так и в соединений, наибольшее промышленное значение из которых имеют медный колчедан (CuFeS2), халькозин Cu2S и борнит Cu5FeS4. Разработка медных месторождений ведется открытым способом.
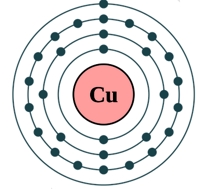
Рис. Строение атома меди.
Электронная конфигурация атома меди — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (см. Электронная структура атомов). У меди один спаренный электрон с внешнего s-уровня «перескакивает» на d-подуровень предвнешней орбитали, что связано с высокой устойчивостью полностью заполненного d-уровня. Завершенный устойчивый d-подуровень меди обусловливает ее относительную химическую инертность (медь не реагирует с водородом, азотом, углеродом, кремнием). Медь в соединениях может проявлять степени окисления +3, +2, +1 (наиболее устойчивые +1 и +2).
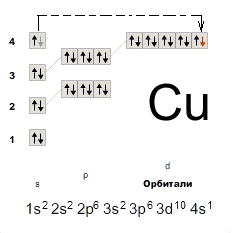
Рис. Электронная конфигурация меди.
Физические свойства меди:
- металл, красно-розового цвета;
- обладает высокой ковкостью и пластичностью;
- хорошей электропроводностью;
- малым электрическим сопротивлением.
Химические свойства меди
- при нагревании реагирует с кислородом:
O2 + 2Cu = 2CuO; - при длительном пребывании на воздухе реагирует с кислородом даже при комнатной температуре:
O2 + 2Cu + CO2 + H2O = Cu(OH)2·CuCO3; - вступает в реакции с азотной и концентрированной серной кислотой:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O; - с водой, растворами щелочей, соляной и разбавленной серной кислотой медь не реагирует.
Соединения меди
Оксид меди CuO (II):
- твердое вещество красно-коричневого цвета, не растворимое в воде, проявляет основные свойства;
- при нагревании в присутствии восстановителей дает свободную медь:
CuO + H2 = Cu + H2O; - оксид меди получают взаимодействием меди с кислородом или разложением гидроксида меди (II):
O2 + 2Cu = 2CuO; Cu(OH)2 = CuO + H2O.
Гидроксид меди Cu(OH2)(II):
- кристаллическое или аморфное вещество голубого цвета, нерастворимое в воде;
- разлагается на воду и оксид меди при нагревании;
- реагирует с кислотами, образуя соответствующие соли:
Cu(OH2) + H2SO4 = CuSO4 + 2H2O; - реагирует с растворами щелочей, образуя купраты — комплексные сооединения ярко-синего цвета:
Cu(OH2) + 2KOH = K2[Cu(OH)4].
Более подробно о соединениях меди см. Оксиды меди.
Получение и применение меди
- пирометаллургическим методом медь получают из сульфидных руд при высоких температурах:
CuFeS2 + O2 + SiO2 → Cu + FeSiO3 + SO2; - оксид меди восстанавливается до металлической меди водородом, угарным газом, активными металлами:
Cu2O + H2 = 2Cu + H2O;
Cu2O + CO = 2Cu + CO2;
Cu2O + Mg = 2Cu + MgO.
Применение меди обусловливается ее высокой электро- и теплопроводностью, а также пластичностью:
- изготовление электрических проводов и кабелей;
- в теплообменной аппаратуре;
- в металлургии для получения сплавов: бронзы, латуни, мельхиора;
- в радиоэлектронике.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
МЕДЬ И ЕЕ СОЕДИНЕНИЯ
УРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕ
Для повышения познавательной активности и самостоятельности учащихся мы используем уроки коллективного изучения материала. На таких уроках каждый ученик (или пара учеников) получает задание, о выполнении которого он должен отчитаться на этом же уроке, причем его отчет фиксируется остальными учениками класса в тетрадях и является элементом содержания учебного материала урока. Каждый ученик вносит свою лепту в изучение темы классом.
В ходе урока меняется режим работы учеников от интраактивного (режим, при котором информационные потоки замкнуты внутри обучаемых, характерен для самостоятельной работы) к интерактивному (режим, при котором информационные потоки двусторонние, т.е. информация идет и от ученика, и к ученику, происходит обмен информацией). Учитель при этом выступает как организатор процесса, корректирует и дополняет информацию, сообщаемую учениками.
Уроки коллективного изучения материала состоят из следующих этапов:
1-й этап – установочный, на котором учитель объясняет цели и программу работы на уроке (до 7 мин);
2-й этап – самостоятельная работа учащихся по инструкции (до 15 мин);
3-й этап – обмен информацией и подведение итогов урока (занимает все оставшееся время).
Урок «Медь и ее соединения» рассчитан на классы с углубленным изучением химии (4 ч химии в неделю), проводится в течение двух академических часов, на уроке актуализируются знания учащихся по следующим темам: «Общие свойства металлов», «Отношение к металлам концентрированной серной кислоты, азотной кислоты», «Качественные реакции на альдегиды и многоатомные спирты», «Окисление предельных одноатомных спиртов оксидом меди(II)», «Комплексные соединения».
Перед уроком учащиеся получают домашнее задание: повторить перечисленные темы. Предварительная подготовка учителя к уроку заключается в составлении инструктивных карточек для учащихся и подготовке наборов для лабораторных опытов.
ХОД УРОКА
Установочный этап
Учитель ставит перед учащимися цель урока: опираясь на имеющиеся знания о свойствах веществ, спрогнозировать, подтвердить практически, обобщить сведения о меди и ее соединениях.
Учащиеся составляют электронную формулу атома меди, выясняют, какие степени окисления может проявлять медь в соединениях, какими свойствами (окислительно-восстановительными, кислотно-основными) будут обладать соединения меди.
В тетрадях учеников появляется таблица.
Свойства меди и ее соединений
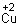
Этап самостоятельной работы
Для подтверждения и дополнения предположений учащиеся выполняют лабораторные опыты по инструкции и записывают уравнения проведенных реакций.
Инструкции для самостоятельной работы парами
1. Прокалите медную проволоку в пламени. Отметьте, как изменился ее цвет. Горячую прокаленную медную проволоку поместите в этиловый спирт. Обратите внимание на изменение ее цвета. Повторите эти манипуляции 2–3 раза. Проверьте, не изменился ли запах этанола.
Запишите два уравнения реакций, соответствующие проведенным превращениям. Какие свойства меди и ее оксида подтверждаются этими реакциями?
2. К оксиду меди(I) прилейте соляную кислоту.
Что наблюдаете? Запишите уравнения реакций, учитывая, что хлорид меди(I) – нерастворимое соединение. Какие свойства меди(I) подтверждаются этими реакциями?
3. а) В раствор сульфата меди(II) поместите гранулу цинка. Если реакция не идет, нагрейте раствор. б) К оксиду меди(II) прилейте 1 мл серной кислоты и нагрейте.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?
4. В раствор сульфата меди(II) поместите полоску универсального индикатора.
Объясните результат. Запишите ионное уравнение гидролиза по I ступени.
К раствору карбоната натрия прилейте раствор сульфата мед(II).
Что наблюдаете? Запишите уравнение реакции совместного гидролиза в молекулярном и ионном видах.
5. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор аммиака.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?
6. К сульфату меди(II) прилейте раствор йодида калия.
Что наблюдаете? Составьте уравнение реакции. Какое свойство меди(II) доказывает эта реакция?
7. В пробирку с 1 мл концентрированной азотной кислоты поместите небольшой кусочек медной проволоки. Закройте пробирку пробкой.
Что наблюдаете? (Пробирку отнесите под тягу.) Запишите уравнение реакции.
В другую пробирку налейте соляной кислоты, поместите в нее небольшой кусочек медной проволоки.
Что наблюдаете? Объясните свои наблюдения. Какие свойства меди подтверждаются этими реакциями?
8. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете? Полученный осадок нагрейте. Что произошло? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?
9. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глицерина.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают эти реакции?
10. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глюкозы и нагрейте.
Что получилось? Запишите уравнение реакции, используя для обозначения глюкозы общую формулу альдегидов
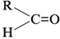 .
.
Какое свойство соединения меди доказывает эта реакция?
11. К сульфату меди(II) прилейте: а) раствор аммиака; б) раствор фосфата натрия.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?
Этап обмена информацией и подведение итогов
Учитель задает вопрос, касающийся свойств конкретного вещества. Учащиеся, выполнявшие соответствующие опыты, докладывают о проведенном эксперименте и записывают уравнения реакций на доске. Затем учитель и ученики дополняют сведения о химических свойствах вещества, которые невозможно было подтвердить реакциями в условиях школьной лаборатории.
Порядок обсуждения химических свойств соединений меди
1. Как медь реагирует с кислотами, с какими еще веществами может реагировать медь?
Записываются уравнения реакций меди с:
• концентрированной и разбавленной азотной кислотой:
• концентрированной серной кислотой:
• соляной кислотой в присутствии кислорода:
2. Какие свойства проявляют оксид и хлорид меди(I)?
Обращается внимание на осно’вные свойства, способность к комплексообразованию, окислительно-восстановительную двойственность. Записываются уравнения реакций оксида меди(I) с:
• соляной кислотой до образования CuCl:
• реакций восстановления и окисления Cu2O:
• диспропорционирования при нагревании:
3. Какие свойства проявляет оксид меди(II)?
Обращается внимание на осно’вные и окислительные свойства. Записываются уравнения реакций оксида меди(II) с:
CuO + 2H + = Cu 2+ + H2O;
4. Какие свойства проявляет гидроксид меди(II)?
Обращается внимание на окислительные, осно’вные свойства, способность к комплексообразованию с органическими и неорганическими соединениями. Записываются уравнения реакций с:
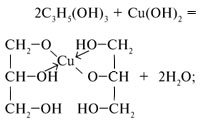
• уравнение реакции разложения:
5. Какие свойства проявляют соли меди(II)?
Обращается внимание на реакции ионного обмена, гидролиза, окислительные свойства, комплексообразование. Записываются уравнения реакций сульфата меди с:
3Cu 2+ + 2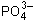 = Cu3(PO4)2;
= Cu3(PO4)2;
Cu 2+ + Zn = Cu + Zn 2+ ;
и уравнения реакций:
Cu 2+ + HOH = CuOH + + H + ;
• совместного гидролиза с карбонатом натрия с образованием малахита:
2Cu 2+ + 2 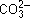 + H2O = (CuOH)2CO3
+ H2O = (CuOH)2CO3 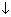 + CO2
+ CO2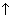 .
.
В дополнение можно рассказать учащимся о взаимодействии оксида и гидроксида меди(II) с щелочами, что доказывает их амфотерность:
Подводится итог: с повышением степени окисления возрастают окислительные свойства соединений меди. Ионы меди способны к комплексообразованию. У соединений меди проявляются осно’вные свойства, хотя оксид и гидроксид меди(II) в жестких условиях могут реагировать с щелочами, проявляя слабую амфотерность.
Оставшееся время урока можно потратить на выполнение упражнений и решение расчетных задач.
Упражнение 1. Осуществите цепочку превращений:
Cu 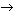 CuCl2
CuCl2 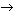 Cu(OH)2
Cu(OH)2 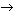 CuO
CuO 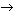 CuSO4
CuSO4 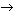 Cu(NO3)2
Cu(NO3)2 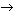 CuO
CuO 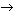 Cu.
Cu.
Упражнение 2. Предложите не менее восьми способов получения хлорида меди(II).
Упражнение 3. Составьте цепочки превращений, соответствующие следующим схемам, и осуществите их:
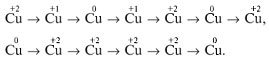
Задача 1. Сплав меди с алюминием обработали сначала избытком щелочи, а затем избытком разбавленной азотной кислоты. Вычислите массовые доли металлов в сплаве, если известно, что объемы газов, выделившихся в обеих реакциях (при одинаковых условиях), равны между собой
[1, с. 237, № 1464].
(Ответ. Массовая доля меди – 84%.)
Задача 2. При прокаливании 6,05 г кристаллогидрата нитрата меди(II) получено 2 г остатка. Определите формулу исходной соли [2, с. 204, № 836].
Задача 3. Медную пластинку массой 13,2 г опустили в 300 г раствора нитрата железа(III) с массовой долей соли 0,112. Когда ее вынули, оказалось, что массовая доля нитрата железа(III) стала равной массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [2, с. 204, № 841].
(Ответ. 10 г.)
Домашнее задание. Выучить материал, записанный в тетради. Составить цепочку превращений по соединениям меди, содержащую не менее десяти реакций, и осуществить ее.
ЛИТЕРАТУРА
1. Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Программы. Вопросы, упражнения, задачи. Образцы экзаменационных билетов. М.: Высшая школа, 1999, 575 с.
2. Кузьменко Н.Е., Еремин В.В. 2000 задач и упражнений по химии. Для школьников и абитуриентов. М.: 1-я Федеративная книготорговая компания, 1998, 512 с.
Характерные химические свойства меди
Медь расположена в IB группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d 9 4s 2 , однако вследствие устойчивости d 10 -состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d 10 4s 1 . В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
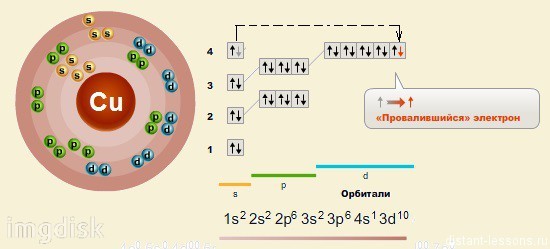
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см 3 .

На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 о С металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
С концентрированной горячей соляной кислотой:
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:

Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:

Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Физические и химические свойства меди
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.

Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет. Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).

Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.

Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.

Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа. В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.

Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами. Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.

