Что такое температура плавления в физике
Что такое плавление в физике? Определение, формула

Вся наблюдаемая в природе материя существует в 3 состояниях: газообразном, жидком и твердом. Нахождение вещества в конкретном состоянии определяется его физико-химическими свойствами, а также внешними условиями. В статье подробно рассматривается процесс перехода материи из твердого состояния в жидкое, то есть дается развернутый ответ на вопрос: «Что такое плавление?».
Особенности строения твердых и жидких тел

Перед тем как дать ответ на вопрос о том, что такое плавление, следует рассмотреть особенности строения твердых и жидких тел.
Первые характеризуются наличием постоянной формы, любому изменению которой они оказывают сопротивление. Твердые тела обладают упругостью, отсутствием текучести. Расстояния между частицами, образующими твердое тело, являются небольшими, а силы связи между этими частицами являются значительными в сравнении с таковыми для жидкостей и газов. Силы связи в твердых телах могут иметь различную химическую природу (ван-дер-ваальсовые, металлические, ковалентные, ионные). Существует два способа организации твердых тел:
- кристаллические структуры, когда атомы или молекулы тела расположены в определенных позициях в пространстве, например, металлы;
- аморфные структуры, в которых атомы или молекулы расположены хаотичным способом, например, стекло.
В жидкостях атомы и молекулы расположены дальше друг от друга, чем в твердых телах, поэтому они слабее связаны. Жидкость сохраняет объем при данных условиях, но не сохраняет форму и обладает хорошей текучестью. Частицы жидкости расположены хаотично относительно друг друга.
Следует отметить важный момент, атомы или молекулы в твердом теле находятся в определенных положениях, которые они очень медленно изменяют (например, в процессах диффузии), а вот частицы жидкости постоянно перескакивают из одного положения в другое.
Кинетическая и потенциальная энергия
Чтобы понять, что такое плавление в физике, необходимо ясно представлять соотношение кинетической и потенциальной энергии в твердых и жидких телах.
Потенциальная энергия характеризует работу, которую нужно затратить, чтобы распылить данное тело в пространстве на составляющие его частицы. Для описания этой величины вводят понятие энергии связи, которая обозначает работу, необходимую для того, чтобы оторвать от тела один атом или молекулу и удалить его/ее на бесконечность. Например, типичные значения энергии связи для твердых тел составляют несколько электрон-вольт, эти же значения для жидкостей на порядок меньше.
Кинетическая энергия характеризует интенсивность движения атомов и молекул. В случае конденсированных сред эта энергия прямо пропорционально зависит от температуры.
В твердых телах кинетическая энергия при комнатных температурах составляет несколько сотых электрон-вольт, то есть она в 100 раз меньше потенциальной. Атомы и молекулы в твердых телах находятся как бы в потенциальной яме и колеблются около устойчивых определенных положений. Выбраться они могут из этих положений, если флуктуации кинетической энергии окажутся значительными, или если сама потенциальная яма невелика, например, когда поблизости имеется какой-либо дефект.
Кинетическая энергия атомов и молекул в жидкости приблизительно равна их потенциальной энергии, то есть составляет несколько десятых электрон-вольт при комнатной температуре. Это означает, что каждая частица, составляющая жидкость, постоянно перепрыгивает из одного места в другое. Хорошим доказательством этого факта является Броуновское движение.
Определение процесса плавления

Что такое плавление в физике? Определение этому явлению можно дать следующее: под плавлением понимают переход из твердого состояния вещества в жидкое в результате увеличения его температуры. То есть если постоянно нагревать твердое тело, то молекулы или атомы, которые его составляют, начинают увеличивать свою кинетическую энергию. И это происходит до тех пор, пока эта энергия не сравняется с энергией связи, после чего частота прыжков атомов (молекул) значительно возрастает, и твердый материал начинает плавиться.
Яркими примерами плавления являются процессы таяния льда или переход в расплавленное состояние какого-либо металла или сплава.
Плавление — фазовый переход первого рода

Согласно своему определению, плавление является переходом первого рода, поскольку при нем происходит поглощение теплоты. При этом температура всей системы в процессе плавления не изменяется и является постоянной величиной. Этот факт объясняется тем, что подводимое к телу тепло расходуется не на увеличение кинетической энергии атомов и молекул, а на разрыв прочных химических связей между ними. Только после того, как все связи в твердом теле будут разрушены, дальнейший подвод тепла к уже жидкому веществу приведет к увеличению его температуры.
Сам процесс плавления не происходит спонтанно, а развивается в определенном промежутке времени, когда жидкая и твердая фазы сосуществуют в равновесии друг с другом.
Таким образом, плавление — это эндотермический процесс, что означает, что он идет с поглощением теплоты. Обратный процесс, при котором жидкость затвердевает, называется кристаллизацией.
Температура плавления
Как было сказано выше, плавление происходит при определенной температуре, которая называется точкой плавления. От чего зависит эта физическая величина? Во-первых, от энергии связи частиц, составляющих твердое тело, чем эта энергия больше, тем больше температура плавления. Например, тугоплавкий металл ниобий плавится при температуре 2742 К, а энергия связи на атом у этого металла равна 7,6 эВ, другой тугоплавкий металл вольфрам, имеет энергию связи 8,9 эВ и плавится при значительно большей температуре 3695 К.
Во-вторых, точка плавления определяется внешними условиями. В частности, при увеличении давления она также возрастает.
В-третьих, на эту величину для данного вещества сильно влияют примеси. Как правило, примеси приводят к понижению точки плавления.
Теплота плавления
Теперь перейдем от определения плавления к формуле, которая количественно описывает этот процесс. Когда происходит плавление, то внешний подвод тепла расходуется на разрыв связей в твердом теле и его перевод в жидкое состояние. Энергия, которую необходимо затратить, чтобы определенное количество твердого вещества, находящегося при температуре плавления, перешло в жидкое состояние называется теплотой плавления. Формула в этом случае записывается так: λ=Q/m, где Q — количество теплоты, m — масса тела.
Значение теплоты плавления λ зависит от физико-химических свойств материала. Например, для льда это значение составляет 333,55 Дж/г или 6,02 кДж/моль, а для железа 13,81 кДж/моль. Значения приведены при давлении 1 атмосфера.
Плавления кристаллов
Эти твердые тела представляют собой определенное пространственное расположение частиц, которые их образуют. Оно известно под названием кристаллической решетки. Существуют много разных кристаллических решеток, каждая из которых реализуется в определенном классе веществ. Например, металлы, как правило, существуют в виде ОЦК (объемно-центрированная кубическая) и ГЦК (гранецентрированная кубическая) решеток. Понятие о температуре плавления справедливо только для кристаллов.
Плавление аморфных тел

Поскольку в аморфных материалах атомы (молекулы) расположены хаотически, то и энергии связей между ними будут различными. Этот факт объясняет, почему для аморфных материалов не существует определенной точки плавления, а сам процесс плавления происходит в температурном интервале, который, как правило, составляет несколько десятков градусов.
Молекулярная физика. Плавление и кристаллизация.
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристаллизацией. Температура, при которой вещество кристаллизуется, называется температурой кристаллизации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.

Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени tнач = -40 °С (точка А на графике). При дальнейшем нагревании температура льда растет (на графике это участок АВ). Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает гореть и тепло, следовательно, подводится. Процессу плавления соответствует горизонтальный участок графика ВС. Только после того как весь лед расплавится и превратится в воду, температура снова начинает подниматься (участок CD). После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой поместить в другой, больший сосуд со льдом). Температура воды начинает снижаться (участок DE). При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (горизонтальный участок EF). Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK).
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD) означает увеличение кинетической энергии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвердевании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, превращаясь в жидкость (участок ВС). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими (титан, хром, молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С. Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ .
Наличие определенной точки плавления — это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества (в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления .
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой 1 кг выделяются те же 332 Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m, следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания .
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива. Удельную теплоту сгорания обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q, выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Что такое температура плавления в физике
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру 10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*10 5 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*10 5 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm .
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Плотность, температура плавления и кипения простых веществ
 В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
Указаны плотность и температуры плавления и кипения следующих простых веществ: азот N2, актиний Ac, алюминий Al, америций Am, аргон Ar, астат At, барий Ba, бериллий Be, бор B, бром Br, ванадий V, висмут Bi, водород H2, вольфрам W, гадолиний Gd, галлий Ga, гафний Hf, гелий He, германий Ge, гольмий Ho, диспрозий Dy, европий Eu, железо Fe, золото Au, индий In, йод (иод) J, иридий Ir, иттербий Yb, иттрий Y, кадмий Cd, калий K, кальций Ca, кислород O2, озон O3, кобальт Co, кремний Si, криптон Kr, ксенон Xe, кюрий Cm, лантан La, литий Li, лютеций Lu, магний Mg, марганец Mn, медь Cu, молибден Mo, мышьяк As, натрий Na, неодим Nd, неон Ne, нептуний Np, никель Ni, ниобий Nb, олово Sn, осмий Os, палладий Pd, платина Pt, плутоний Pu, полоний Po, празеодим Pr, прометий Pm, протактиний Pa, радий Ra, радон Rn, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, самарий Sm, свинец Pb, селен Se, сера S, серебро Ag, скандий Sc, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, тербий Tb, технеций Tc, титан Ti, торий Th, тулий Tu, углерод C (алмаз, графит), уран U, фосфор P (белый, красный), франций Fr, фтор F, хлор Cl, хром Cr, цезий Cs, церий Ce, цинк Zn, цирконий Zr, эрбий Er.
Следует отметить, что плотность веществ в таблице выражена в размерности кг/м 3 . В таблице можно выделить вещества (химические элементы) с минимальной и максимальной плотностью. Наименьшей плотностью из химических элементов обладают газы — например, плотность водорода равна всего 0,08987 кг/м 3 — это самый легкий газ на планете. Из тяжелых элементов высокой плотностью отличаются вольфрам, уран, нептуний, осмий и другие металлы.
Цифры в скобках означают, что вещество при данной температуре разлагается. Сокращения: г. — газ, ж. — жидкость, тв. — твердое вещество, возг. — возгоняется, ромб. — ромбическая структура.
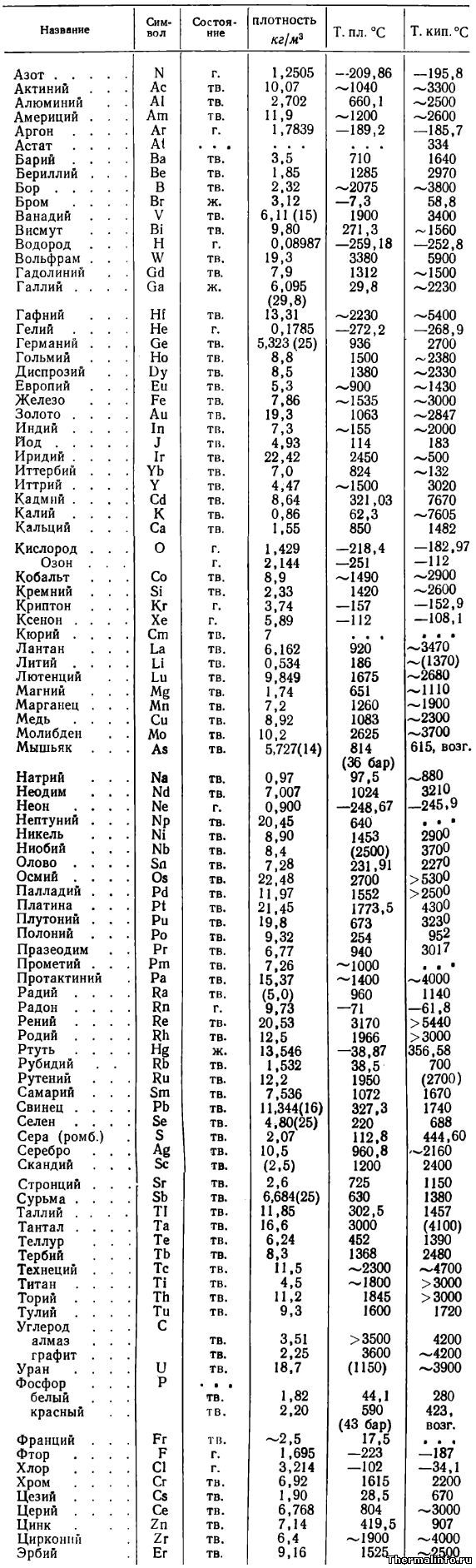
По данным таблицы можно выделить вещества, обладающие минимальной и максимальной температурой плавления и кипения. Самую низкую температуру плавления имеет химический элемент гелий — его температура плавления равна минус 272,2 °С. Гелий также обладает и самой низкой температурой кипения.
Самую высокую температуру плавления среди простых веществ имеет такой химический элемент, как углерод в виде графита. Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Самую высокую температуру кипения имеет элемент кадмий, он кипит при температуре не ниже 7670°С, хотя начинает плавиться всего лишь при 321°С.
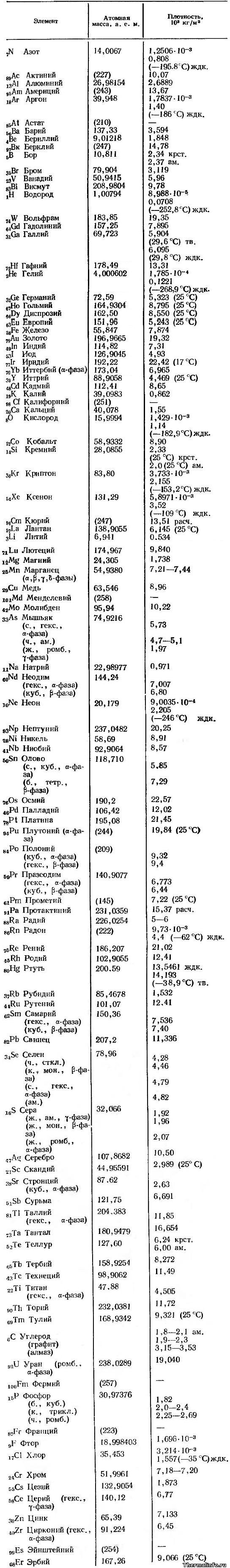
Атомная масса и плотность простых веществ
В таблице приведена атомная масса и плотность следующих химических элементов: азот ,актиний, алюминий, америций, аргон, астат, барий, бериллий, берклий, бор, бром, ванадий, висмут, водород, вольфрам, гадолиний, галлий, гафний, гелий, германий, гольмий, диспрозий, европий, железо, золото, индий, йод, иридий, иттербий, иттрий, кадмий, калий, калифорний, кальций, кислород, кобальт, кремний, криптон, ксенон, кюрий, лантан, литий, лютеций, магний, марганец, медь, менделевий, молибден, мышьяк, натрий, неодим, неон, нептуний, никель, ниобий, олово, осмий, палладий, платина, плутоний, полоний, празеодим, прометий, протактиний, радий, радон, рений, родий, ртуть, рубидий, рутений, самарий, свинец, селен, сера, серебро, скандий, стронций, сурьма, таллий, тантал, теллур, тербий, технеций, титан, торий, тулий, углерод (графит, алмаз), уран, фермий, фосфор, франций, фтор, хлор, хром, цезий, церий, цинк, цирконий, эйнштейний, эрбий.
Указанные значения плотности соответствуют плотности веществ при температуре 20°С и атмосферном давлении, за исключением тех случаев, когда в скобках указана другая температура.
Плотность элементов дана в размерности тонна на кубометр. Например, плотность жидкого азота при температуре -195,8°С равна 0,808 т/м 3 или 808 кг/м 3 ; плотность хлора в газообразном состоянии равна 3,214 кг/м 3 , жидкого — 1557 кг/м 3 . Значения плотности веществ приведены для их естественного молекулярного и агрегатного состояний при указанной температуре.
 Источники:
Источники:
1. Писаренко В.В. Справочник лаборанта-химика. Справ. пособие для проф.-техн. учебн. заведений. М., «Высшая школа», 1970. — 192 стр. с илл.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Определение температуры плавления
Температурой плавления веществаназывают температуру, при которой его твердая фаза находится в равновесии с собственным расплавом.
Температура плавления – важнейшая характеристика соединения. По значению температуры плавления можно проводить идентификацию соединения, так как эта константа всегда приводится в справочниках по свойствам соединений, например, /2, 4/.
Для идентификации веществ часто используют также т. н. «смешанную пробу плавления». Для этого тщательно смешивают равные количества вещества, которое идентифицируют, и заведомо известного вещества. Если температура плавления смеси остается неизменной, то делают заключение об идентичности обоих веществ. Если же температура плавления пробы ниже температуры плавления исходных веществ, то, следовательно, эти вещества различны. Это способ основан на установленном факте, что чистые вещества обладают четко выраженной («резкой») температурой плавления (с точностью до 0,01 °С). Наличие примесей, как правило, понижает температуру плавления. Кроме того, вещества, содержащие какие-либо примеси, плавятся в температурном интервале,т. е. не имеют четко выраженной температуры плавления. Таким образом, определение температуры плавления может дать качественную информацию о степени чистоты вещества.
Определение температуры плавления позволяет также сделать косвенные выводы о возможном молекулярном строении вещества. Например, установлено, что изомеры с симметричными молекулами плавятся при более высокой температуре, чем вещества менее симметричного строения. Температура плавления растет также с увеличением степени ассоциации молекул (например, вследствие межмолекулярных водородных связей).
Приблизительно оценить температуру плавления вещества можно, используя обычный лабораторный термометр. Несколько кристаллов исследуемого соединения аккуратно помещают непосредственно на ртутный шарик термометра. Далее термометр с кристаллами осторожно располагают над поверхностью предварительно нагретой электроплитки с закрытой спиралью. Регулируя высоту положения термометра над нагретой поверхностью, грубо задают скорость подъема температуры. Внимательно наблюдая попеременно за состоянием кристаллов и значением температуры, отмечают начало плавления вещества (появление первых капелек жидкой фазы). Этот процесс можно повторить несколько раз, добиваясь наиболее точного определения начала процесса плавления. Разумеется, этот метод дает только приблизительное представление о температуре плавления, однако он позволяет существенно упростить дальнейший эксперимент по точному определению этой константы.
Для точного определения температуры плавления существует несколько конструктивно отличающихся приборов различной степени сложности и удобства в работе, однако принцип их работы одинаков. Исследуемое соединение помещают в стеклянный капилляр (диаметр 1 мм, длина 40 – 50 мм), запаянный с одного конца. Предварительно вещество растирают в ступке в тонкий порошок. Для заполнения капилляра его открытый конец погружают в порошок, при этом некоторое количество вещества попадает в верхнюю часть капилляра. Далее (для перемещения вещества в нижнюю часть капилляра и уплотнения слоя) капилляр бросают запаянным концом вниз в длинную, узкую, вертикально поставленную стеклянную трубку (диаметр
10 мм, длина 40 – 50 см). Повторяя этот прием несколько раз, добиваются получения плотного слоя вещества в капилляре высотой 3-5 мм.
Непосредственное определение температуры плавления производится в специальном стеклянном приборе (рисунок 5), состоящем из круглодонной колбы (1) с высококипящим теплоносителем, пробирки (2) и термометра (3). Капилляр (4) с испытуемым веществом прикрепляют к термометру колечком из резиновой трубки (5) так, чтобы столбик вещества находился на уровне середины ртутного шарика. Прибор нагревают на воздушной бане (колбонагреватель, электроплитка) сначала быстро, а последние 15-20° ниже предполагаемой температуры плавления температуру повышают со скоростью не более 2 град · мин –1 . Точкой плавления считают температуру в момент полного расплавления вещества.
Обычно вещество плавится в интервале температур и этот интервал тем меньше, чем чище вещество. Началом плавления считают момент появления первой капли в капилляре, а окончанием – исчезновение последних кристалликов вещества.
Плавление тел (стр. 1 из 3)
Присяжнюк Ольга 9-А
Невзорова Татьяна Игоревна
1) Расчет количества теплоты
3) Удельная теплота плавления
4) Плавление металлов
5) Температура плавления и кипения воды
7) Интересное о плавлении
Список использованной литературы
Агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состоянием причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния суть термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Твёрдое тело: Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость: Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ: Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Другие состояния: При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности. Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.

Рис. 1. Состояние чистого вещества (диаграмма)

Рис. 2. Температура плавления кристаллического тела

Рис. 3. Температура плавления щелочных металлов

Плавление — переход вещества из кристаллического (твёрдого) состояния в жидкое; происходит с поглощением теплоты (фазовый переход I рода). Главными характеристиками П. чистых веществ являются температура плавления (Тпл) и теплота, которая необходима для осуществления процесса П. (теплота плавления Qпл).
Температура П. зависит от внешнего давления р; на диаграмме состояния чистого вещества эта зависимость изображается кривой плавления (кривой сосуществования твёрдой и жидкой фаз, AD или AD’ на рис. 1). П. сплавов и твёрдых растворов происходит, как правило, в интервале температур (исключение составляют эвтектики с постоянной Тпл). Зависимость температуры начала и окончания П. сплава от его состава при данном давлении изображается на диаграммах состояния специальными линиями (кривые ликвидуса и солидуса, см. Двойные системы). У ряда высокомолекулярных соединений (например, у веществ, способных образовывать жидкие кристаллы) переход из твёрдого кристаллического состояния в изотропное жидкое происходит постадийно (в некотором температурном интервале), каждая стадия характеризует определённый этап разрушения кристаллической структуры.
Наличие определённой температуры П.— важный признак правильного кристаллического строения твёрдых тел. По этому признаку их легко отличить от аморфных твёрдых тел, которые не имеют фиксированной Тпл. Аморфные твёрдые тела переходят в жидкое состояние постепенно, размягчаясь при повышении температуры (см. Аморфное состояние). Самую высокую температуру П. среди чистых металлов имеет вольфрам (3410 °С), самую низкую — ртуть (—38,9 °С). К особо тугоплавким соединениям относятся: TiN (3200 °С), HfN (3580 °С), ZrC (3805 °С), TaC (4070 °С), HfC (4160 °С) и др. Как правило, для веществ с высокой Тпл характерны более высокие значения Qпл. Примеси, присутствующие в кристаллических веществах, снижают их Тпл. Этим пользуются на практике для получения сплавов с низкой Тпл (см., например, Вуда сплав с Тпл = 68 °С) и охлаждающих смесей.
П. начинается при достижении кристаллическим веществом Тпл. С начала П. до его завершения температура вещества остаётся постоянной и равной Тпл, несмотря на сообщение веществу теплоты (рис. 2). Нагреть кристалл до Т > Тпл в обычных условиях не удаётся (см. Перегрев), тогда как при кристаллизации сравнительно легко достигается значительное переохлаждение расплава.
Характер зависимости Тпл от давления р определяется направлением объёмных изменений (DVпл) при П. (см. Клапейрона — Клаузиуса уравнение). В большинстве случаев П. вещества сопровождается увеличением их объёма (обычно на несколько %). Если это имеет место, то возрастание давления приводит к повышению Тпл (рис. 3). Однако у некоторых веществ (воды, ряда металлов и металлидов, см. рис. 1) при П. происходит уменьшение объёма. Температура П. этих веществ при увеличении давления снижается.
П. сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления [исключение составляют некоторые полуметаллы (Bi, Sb) и полупроводники (Ge), в жидком состоянии обладающие более высокой электропроводностью]. Практически до нуля падает при П. сопротивление сдвигу (в расплаве не могут распространяться поперечные упругие волны, см. Жидкость), уменьшается скорость распространения звука(продольных волн) и т.д.
Согласно молекулярно-кинетическим представлениям, П. осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др., см. Дефекты в кристаллах). В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается П.— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при П. теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах (см. Дальний порядок и ближний порядок). В самих же субмикроскопических областях ближний порядок в расположении атомов при П. существенно не меняется (координационное число расплава при Тпл в большинстве случаев остаётся тем же, что и у кристалла). Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их П.
Процесс П. играет важную роль в природе (П. снега и льда на поверхности Земли, П. минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Удельная теплота плавления
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества). Теплота плавления — частный случай теплоты фазового перехода I рода. Различают удельную теплоту плавления (Дж/кг) и молярную (Дж/моль).
Удельная теплота плавления обозначается буквой

